Las Autoridades Sanitarias Españolas han incluido cabozantinib (Cabometyx®) en el sistema nacional de prestación farmacéutica. Se trata de un nuevo fármaco que la compañía biofarmacéutica Ipsen pone a disposición de los pacientes en España para el tratamiento del carcinoma de células renales avanzado en pacientes que hayan recibido tratamiento antiangiogénico previo. Cabometyx® tiene un mecanismo de acción único dirigido a los receptores MET, AXL y VEGFR, que intervienen en la función celular y en procesos fisiológicos como la angiogénesis (proceso de generación de vasos sanguíneos, que nutren las células tumorales), la metástasis o la resistencia farmacológica de los tumores. En este sentido, y según datos del estudio Meteor de fase III, cabozantinib se presenta como una nueva opción de tratamiento para aquellos pacientes con cáncer renal avanzado que han recibido terapias previas dirigidas al factor del crecimiento endotelial vascular (VEGF). Concretamente, Cabometyx® es la primera y única terapia dirigida multidiana oral en segunda línea que mejora la supervivencia global, la supervivencia libre de progresión y la tasa de respuesta objetiva, administrado una vez al día1-2.
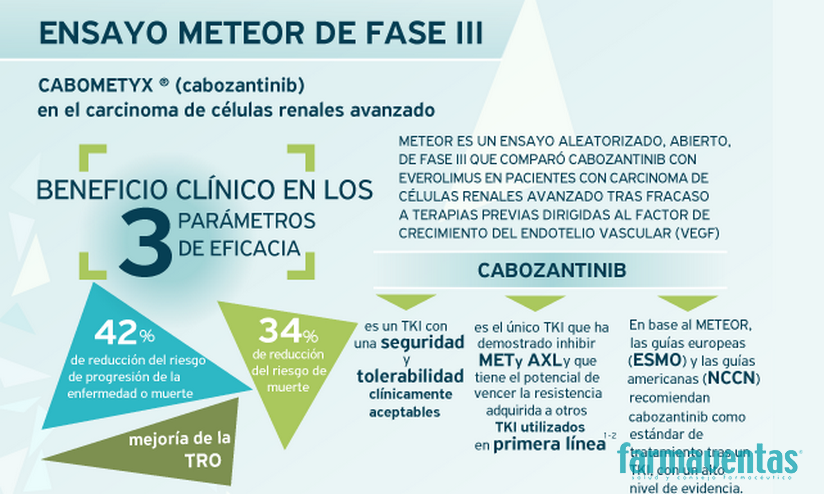
El estudio internacional Meteor, publicado en las prestigiosas revistas The New England Journal of Medicine y The Lancet Oncology, determinó la superior eficacia de cabozantinib frente a everolimus en pacientes con carcinoma de células renales avanzado que habían progresado a un tratamiento previo con inhibidores de tirosin quinasa. En comparación con everolimus, cabozantinib mostró de forma significativa una reducción del 34% en el riesgo de muerte (supervivencia global); una reducción del 42% en el riesgo de progresión de la enfermedad o muerte (supervivencia libre de progresión) y una mejor tasa de respuesta objetiva (reducción del tumor) 1-2. Este estudio multinacional contó con una importante participación española, incluyendo varios centros hospitalarios universitarios. Además, cabe destacar que, tras recibir la autorización europea, durante la fase de inclusión en el sistema nacional de salud, Ipsen puso en marcha un programa de acceso gratuito para pacientes candidatos a ser tratados con este fármaco.